연구성과
윤여준·오동찬 교수팀, 거대 모듈화 非리보좀 펩타이드 합성효소의 특이 생합성 메카니즘 최초 규명
△ (그림1) 본 연구에서 규명된 WS9326의 생합성 경로 및 유도체의 구조
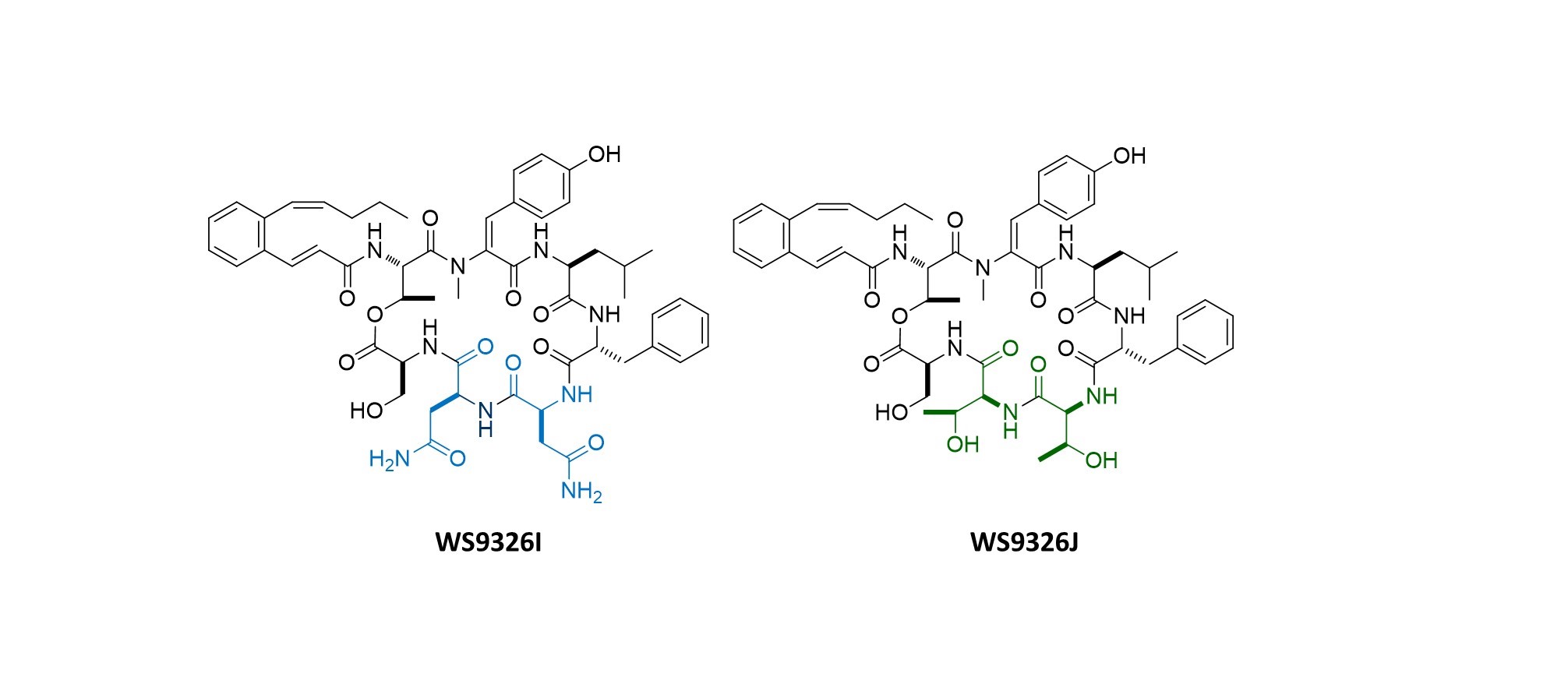
△ (그림2) 본 연구를 통하여 창출한 신규 천연물의 구조

△ 왼쪽부터 윤여준 교수, 오동찬 교수, 김면수 박사, 배문형 박사
본교 윤여준 교수팀, 오동찬 교수팀 및 이화여자대학교 화학나노과학과 차선신 교수팀은 공동연구를 통하여, 해양 미생물의 모듈화된 형태의 거대 非리보좀 펩타이드 합성효소(nonribosomal peptide synthetase, NRPS)에 의한 WS9326A라는 유용생리활성물질의 생합성이 현재까지 알려지지 않았던 특이 메카니즘에 의해 이루어진다는 것을 세계 최초로 규명하였습니다.
일반적으로 생체 내 단백질 등 펩타이드는 리보좀에 의해 만들어집니다. 그러나 의약품 등으로 사용되는 유용한 생리활성의 비교적 작은 분자량의 고리형 펩타이드는 리보좀이 아닌 모듈화된 형태의 거대 非리보좀 펩타이드 합성효소(nonribosomal peptide synthetase, NRPS)에 의해서 생합성됩니다. 인류 최초의 항생제인 페니실린이 진균의 NRPS에 의해서 만들어지는 가장 대표적인 의약품이며, 그밖에 대표적으로 항생제(반코마이신), 항암제(블레오마이신), 면역억제제(사이클로스포린)와 같은 의약품들이 미생물의 NRPS에 의해 생합성되는 것으로 알려져 있습니다. NRPS는 아미노산을 선택하여 활성화하는 도메인(A domain), 아미노산을 연결하여 펩타이드 결합을 만드는 도메인(C domain), 합성 중인 펩타이드 사슬을 붙잡고 있는 도메인(T domain)으로 이루어진 모듈이 최종 산물인 고리형 펩타이드 구조 내 아미노산의 구성 순서대로 작용하는 것으로 알려져 있습니다. 즉, NRPS를 구성하는 모듈의 순서와 수가 최종 펩타이드 구조의 아미노산의 순서와 수에 상응하는 것(colinearity rule)입니다.
WS9326A는 타키키닌(tachykinin) 수용체에 대한 작용을 통해 천식 증상에 대한 완화효과를 보이며, 세포의 신생혈관 생성을 억제하는 효능을 보이는 것으로 알려져 있습니다. 본 연구팀은 해양 유래 방선균 스트렙토마이세스 종 SNM55로부터 WS9326A를 생합성하는 NRPS를 암호화하는 유전자 집단을 확인하였으며, 지금까지의 전형적인 NRPS와는 매우 다른 도메인과 모듈구조로 구성된 것을 발견하였습니다. 특히, 위치특이적 돌연변이를 통한 NRPS 도메인 활성제거, 각 NRPS 단백질간의 상호작용 특이성 규명 및 주요 단백질의 3차원 결정구조 규명 등을 통하여, 이 비정형 NRPS가 지금까지 알려진 작동 원리를 따르지 않고 특정 모듈들은 반복 사용되거나 또는 사용되지 않으며, 독립적으로 존재하는 도메인과 모듈들이 일반적인 펩타이드 형성과정과는 전혀 다른 방법을 통해 아미노산을 활성화하고 이를 펩타이드로 연결하는 생합성 메카니즘으로 작동하고 있음을 최초로 밝혀내었습니다.(그림 1)
나아가, 규명한 생합성 메카니즘을 기반으로 NRPS 주요 유전자 서열의 변형을 통하여, 기존에 알려져 있던 NRPS의 작동 원리에 대한 이해만으로는 불가능하였던 WS9326A의 신규유도체(WS9326I, WS9326J)를 조합생합성적으로 창출할 수 있었습니다.(그림 2) 이를 통해 환형 WS9326A 유도체의 여섯번째 아미노산 서열인 아스파라진의 존재가 암세포 성장/전이에 필수적인 신생혈관 생성의 억제 효과에 있어서 중요하다는 구조-활성 상관관계를 규명하였습니다.
WS9326A의 생합성 NRPS 효소는 지금까지 보고된 가장 복잡한 형태의 비선형적(nonlinear) NRPS 중 하나로, 이처럼 비정형적 양상을 보이는 생합성효소에 의한 물질 생합성에 대한 구조적, 생화학적, 유전적 정보를 통한 연구와 이해는, 미생물 내 아직 밝혀지지 않은 유용 천연물의 생합성 경로 파악과 생산에 가치 있는 정보를 제공할 수 있습니다. 또한, 본 연구를 기반으로 구조적으로 복잡한 천연물의 조합생합성(화학적 방법이 아닌 생합성 유전자의 조합에 의한 화학구조의 변형 방법)에 대한 획기적인 전략을 제시하여, 천연물 유래 신약개발의 장애 요소인 물질 구조 개량의 어려움을 극복할 수 있을 것입니다. 나아가 유용활성을 지닌 천연물을 조합생합성적으로 효능, 부작용, 물성 측면에서 개량할 수 있는 길을 열어 신규의약품의 개발에 기여할 수 있을 것으로 판단됩니다.
본 연구는 해양수산과학기술진흥원 포스트게놈다부처유전체사업, 해양수산부 극지유래생물자원을 활용한 항생제후보물질개발사업과 한국연구재단의 중견연구[후속]사업, 기초연구실사업, 바이오⸱의료 기술개발사업의 지원 하에 수행되었으며 연구결과는 Angewandte Chemie International Edition(IF 12.959)에 게재되었습니다.(논문명: Unprecedented Noncanonical Features of the Nonlinear Nonribosomal Peptide Synthetase Assembly Line for WS9326A Biosynthesis).

